授权给美国Treeline公司在大中华外的开发、生产和商业化权益,潜在交易总金额超过7亿美元。
同一日获得2个拟纳入突破性疗法认定;2月14日,该子公司又收到国家药监局核准签发关于?
1的《药物临床试验批准通知书》,将于近期开展临床试验。该药也是恒瑞医药ADC药物研发管线中极为重要的一款。
恒瑞医药2月14日晚间公告,子公司上海盛迪医药收到国家药品监督管理局核准签发关于!
其中,2款ADC药物喜报连连,使得恒瑞医药在ADC药物研发领域更上一层楼。目前国内ADC药物研发赛道竞争火热,各大药企当仁不让,全力以赴。前有荣昌生物和科伦药业,后有恒瑞医药和石药集团,另外还有不少企业在跟进。作为国内的创新药“一哥”,恒瑞医药利用强大的研发优势,在ADC药物领域已有重兵把守,极具优势。
2月12日,恒瑞医药发布公告:将自研抗肿瘤新药SHR2554(EZH2 抑制剂)大中华区外开发、生产和商业化权益授予美国Treeline公司,潜在交易总金额超过7亿美元。据悉,截至目前,恒瑞医药在该产品的相关项目上已投入研发费用约8,938万元人民币。签订10日内恒瑞医药将收到1100万美元首付款,较大程度弥合项目已投入近9000万元的研发费用;合作方Treeline公司专注抗肿瘤新药研发,创始人分别曾履职LOXO和诺华公司,有助于加速SHR2554全球研发、拓展海外市场。恒瑞医药作为国内系统平台、研发能力最强的龙头药企之一,内生创新与国际合作并重,全球化发展有望持续稳步推进。
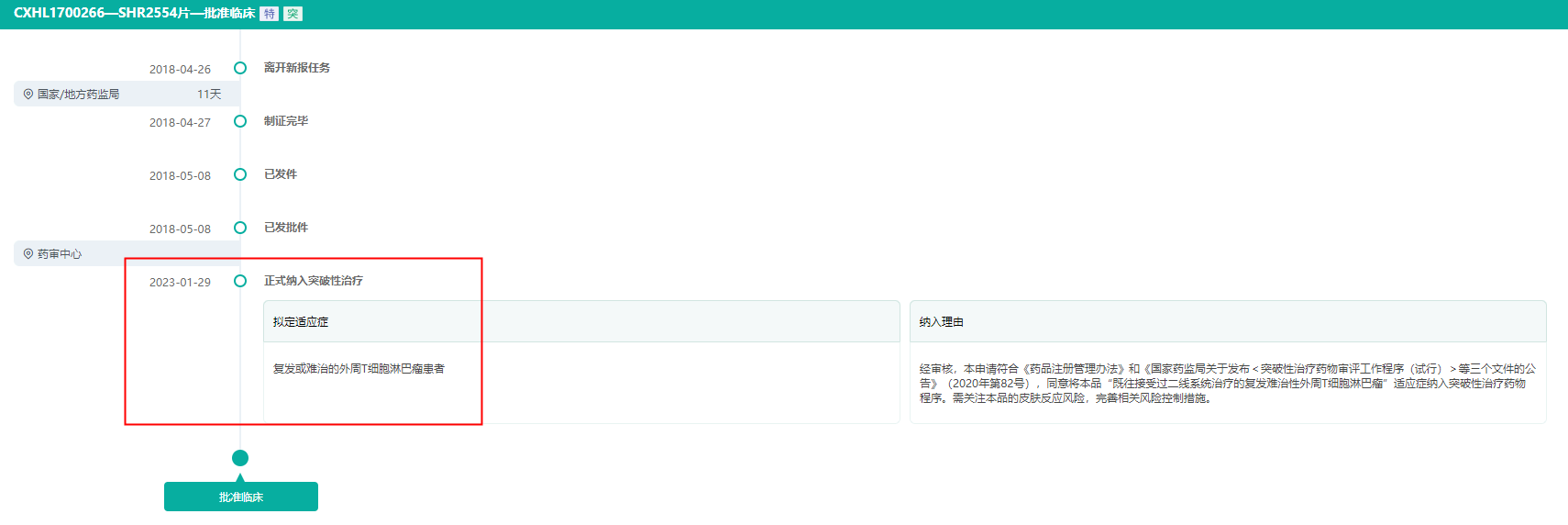
据药融云数据库显示,SHR2554是一款EZH2抑制剂,在国内刚于2023年1月底被国家药监局药品审评中心纳入突破性治疗品种名单,用于复发或难治的外周T细胞淋巴瘤。
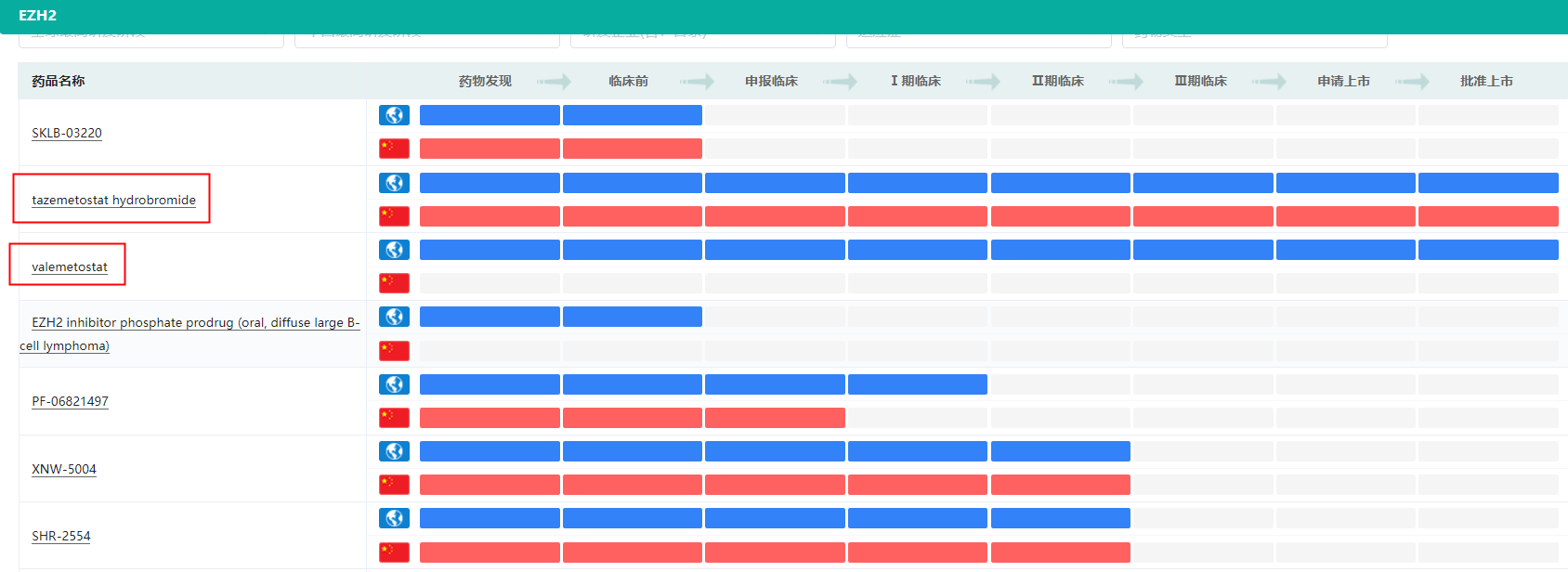
EZH2失调可能推动滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤等多种癌症发生,并与临床疗效和不良预后相关。目前,全球EZH2抑制剂类产品已有2款获批,分别为Epizyme的Tazverik和第一三共的Ezharmia,其中前者由和黄医药引入,已在国内上市。进入临床研究阶段的产品主要来自Constellation(I/II期)、Hanmi(I期)、Pfizer(I期);国内主要参与企业包括恒瑞医药(II期)、海和药物(II期)半岛·BOB官方网站、信诺维(II期)。
2月12日,恒瑞医药子公司苏州盛迪亚生物医药递交的注射用SHR-A1811被国家药品监督管理局药品审评中心拟纳入突破性治疗品种公示名单。同一日获得2个拟纳入突破性疗法认定:拟定用于人表皮生长因子受体2(HER2)阳性的复发或转移性乳腺癌患者;拟定用于人表皮生长因子受体2(HER2)低表达的复发或转移性乳腺癌患者。
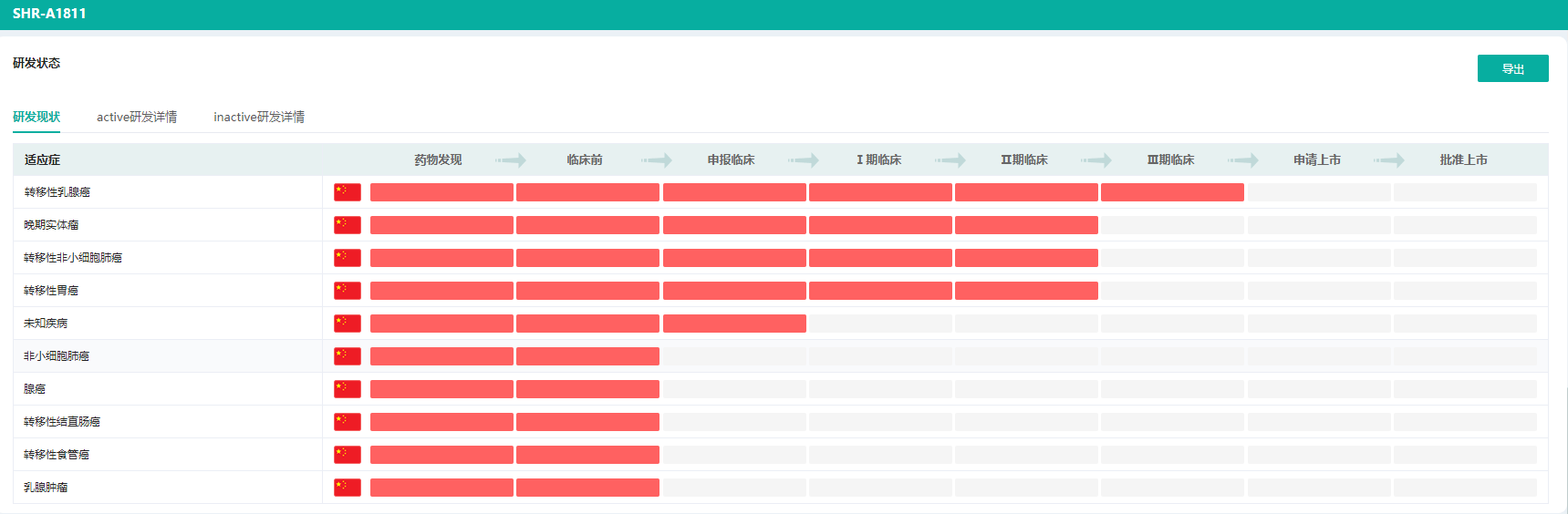
SHR-A1811是恒瑞医药自主研发的、以HER2为靶点的ADC药物。可通过与HER2表达的肿瘤细胞结合并内吞,在肿瘤细胞溶酶体内通过蛋白酶剪切释放毒素,诱导细胞周期阻滞从而诱导肿瘤细胞凋亡。截至2023年2月12日,恒瑞医药已在注射用SHR-A1811相关项目累计已投入研发费用约21,173万元。
SHR-A1811是恒瑞医药的抗肿瘤新药重点研发项目,在2022年6月启动了一项多中心III期临床研究,以评估在HER2阳性转移性乳腺癌患者中SHR-A1811的无进展生存期是否优于抗HER2靶向药吡咯替尼联合卡培他滨。SHR-A1811目前已开展多项I~III期临床研究,涵盖HER2表达或突变的晚期实体瘤、晚期胃癌或胃食管结合部腺癌、结直肠癌、晚期非小细胞肺癌、转移性乳腺癌等。
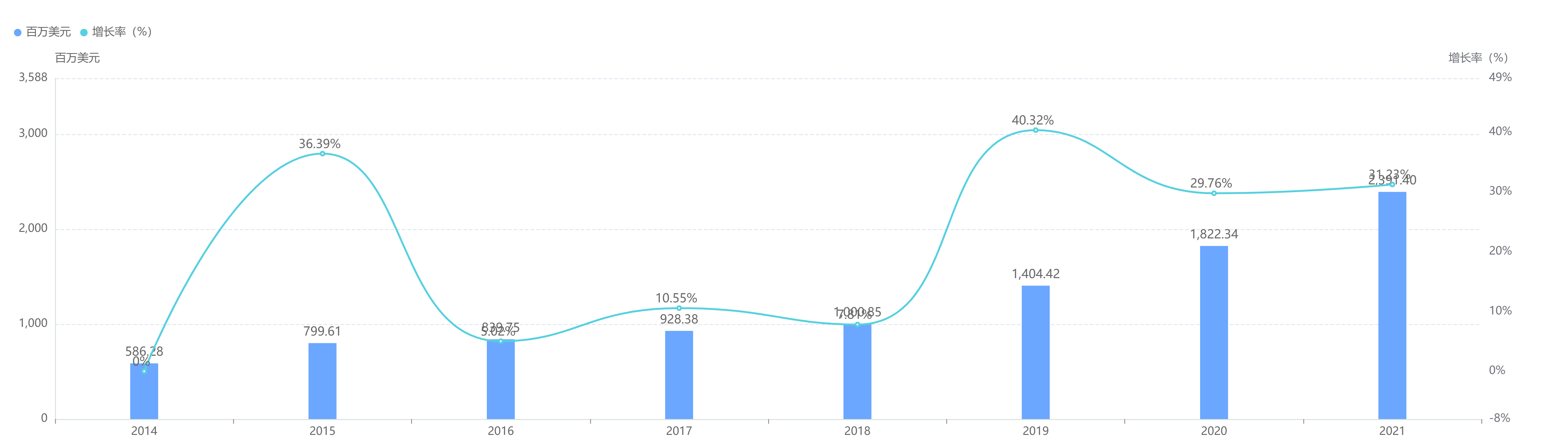
经查询,目前国外已上市的同类ADC药物有罗氏公司研发的恩美曲妥珠单抗(商品名Kadcyla) 、阿斯利康和第一三共合作开发的德曲妥珠单抗(商品名Enhertu)。其中,恩美曲妥珠单抗已于2019年在国内进口上市。国内外另有ARX788、DP303c、A166、RC48、SYD985、BAT8001等多款产品处于临床试验阶段。据药融云统计,2021年罗氏的恩美曲妥珠单抗在全球大卖了23。91亿美元,销售额同比增长了31。23%。
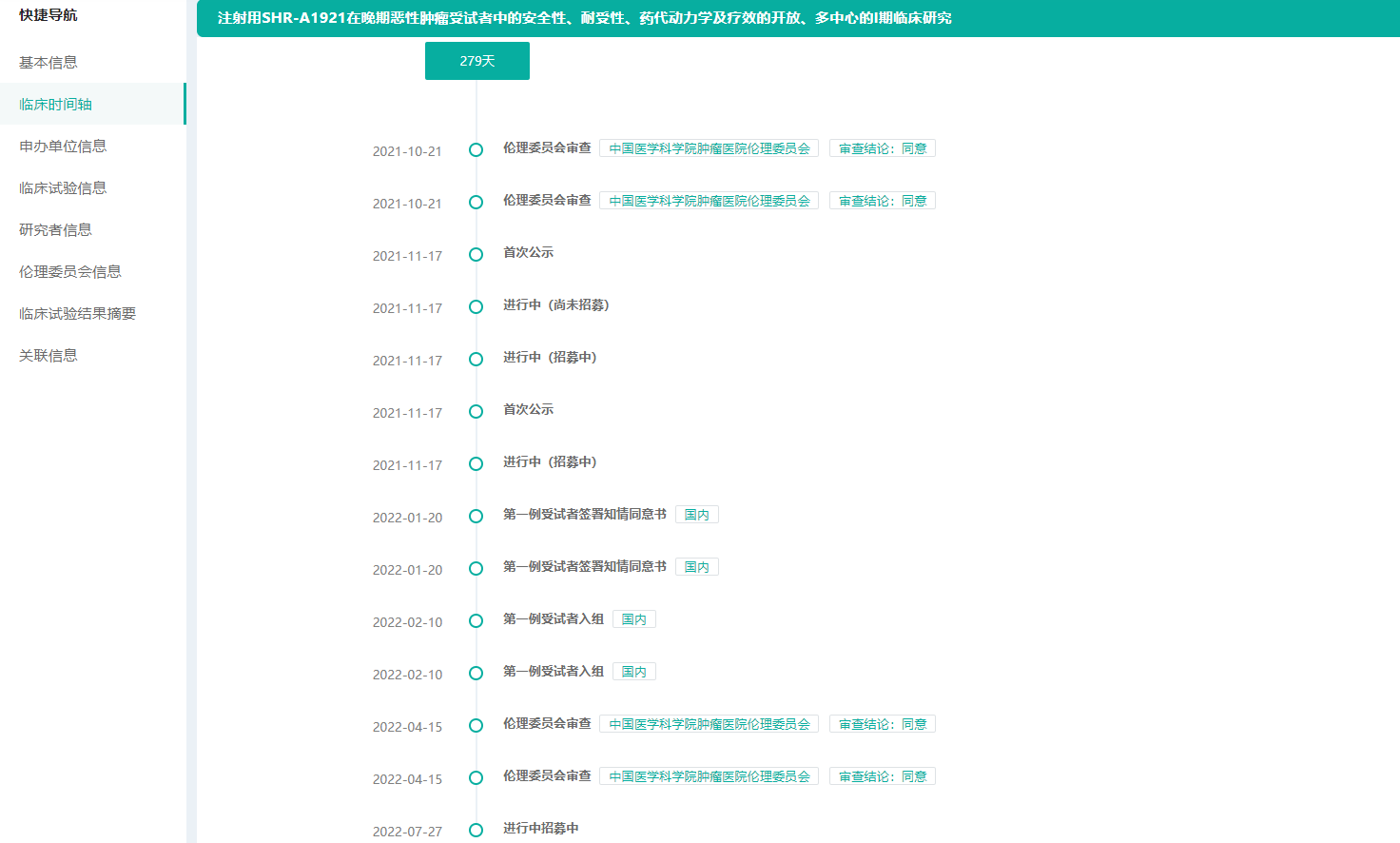
2月14日,恒瑞医药发布公告,子公司苏州盛迪亚生物医药收到国家药监局核准签发关于其创新ADC药物——注射用SHR-A1921的《药物临床试验批准通知书》,将于近期开展临床试验。截至2023年2月14日,恒瑞医药在注射用SHR-A1921相关研发项目累计已投入研发费用约为4,894万元。
经审查,国家药监局同意该品开展临床试验,具体为一项注射用SHR-A1921联合抗肿瘤新药疗法治疗晚期实体肿瘤的开放、多中心Ⅰb/Ⅱ期临床研究。旨在探索SHR-A1921联合阿得贝利单抗±含铂化疗、或联合贝伐珠单抗等其他多种抗肿瘤疗法治疗肺癌等多种晚期实体肿瘤患者的有效性及安全性。
在2021年11月,恒瑞医药已启动注射用SHR-A1921单药在晚期恶性肿瘤受试者中的安全性、耐受性、药代动半岛·体育中国官方网力学及疗效的开放、多中心的I期临床研究。主要临床机构为国家癌症中心和中国医学科学院北京协和医学院肿瘤医院。
阿得贝利单抗是恒瑞医药自主研发的人源化抗PD-L1单克隆抗体抗肿瘤新药,能通过特异性结合PD-L1分子从而阻断导致肿瘤免疫耐受的PD-1/PD-L1通路,重新激活免疫系统的抗肿瘤活性,从而达到治疗肿瘤的目的。截至目前,恒瑞医药在阿得贝利单抗注射液相关项目累计已投入研发费用约3。73亿元。
据药融云数据库显示,2022年1月19日,药审中心承办了1类生物制品阿得贝利单抗注射液(SHR-1316)的上市申请,目前正排队等待审评。这是第5款申报上市的国产PD-L1单抗。
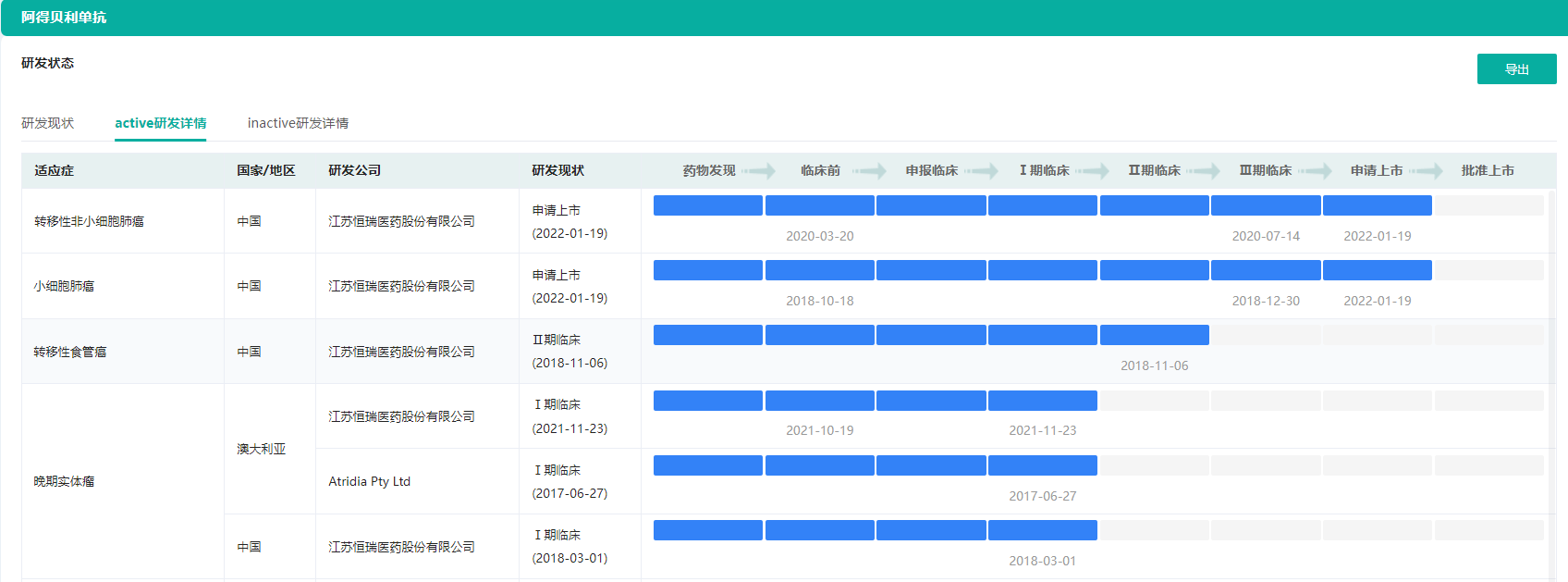
2021年10月,恒瑞医药公布数据显示阿得贝利单抗注射液联合化疗一线治疗广泛期小细胞肺癌(NSCLC)的随机、双盲、安慰剂对照、多中心的III期临床研究(SHR-1316-III-301)主要研究终点结果达到方案预设的优效标准。研究结果表明,阿得贝利单抗联合化疗对比安慰剂联合化疗获得显著且具有临床意义的总生存期(OS)延长。恒瑞医药基于此宣布计划向CDE递交新适应症上市申请的沟通交流申请。国内在售5款,涉及罗氏、辉瑞》,国内企业中,荣昌生物、云顶新耀已有产品获批上市。国内处于III期临床阶段的ADC候选药物超过10款,预计国内在未来2-3年内即将迎来ADC药物的爆发期。ADC药物研发赛道国内竞争火热,但作为龙头企业,恒瑞医药已经具备了明显优势,研发管线将会陆续开花结果。
想要解锁更多药企信息吗?查询药融云数据库(?zmt-sh)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

访问手机版

微信公众号