虽然消灭和根除疾病是公共卫生的终极目标之一,但目前科学界也有部分观点认为,新冠最终可能是将与人类共存。因此,如何通过“疫苗预防+药物治疗”的组合拳将新冠病毒的危害控制在可接受范围内将成关键。
在2020年新冠疫情发生之初,国务院联防联控机制科研攻关组就将疫苗的研发作为主攻方向之一,并同时布局了灭活疫苗、核酸疫苗、重组蛋白疫苗、腺病毒载体疫苗,减毒流感病毒载体疫苗这五条技术路线。
此外,据科技部部长王志刚在今年全国两会期间接受媒体采访时介绍称,各类新冠治疗药物亦在积极开发中。截至目前,已有1个中和抗体药获批附条件上市,另外还有3个小分子药物进入了三期临床试验。
疫苗主要用于感染前的预防。据《科创板日报》记者统计,截至目前,国内有5款疫苗获批附条件上市,还有2款疫苗获紧急使用授权(“附条件批准”与“紧急使用授权”的区别是什么?可戳这里)。
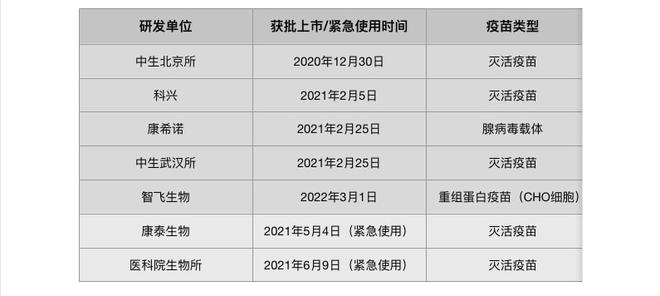
与此同时,据科技部部长王志刚称,目前国内也有已经进入三期临床试验阶段的mRNA疫苗和DNA疫苗。
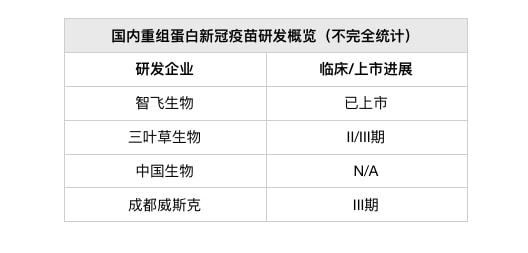
mRNA疫苗是国外获批上市疫苗的主流技术路线。国内有做布局的企业有艾博生物/沃森生物、斯微生物、艾美疫苗、成都威斯津等,其中以艾博生物/沃森生物的ARCoV临床进展最快。
1、艾博生物:艾博生物mRNA新冠疫苗(ARCoV)由军事医学科学院、艾博生物及沃森生物(300142。SZ)联合开发。
2020年6月,ARCoV获得国内首个mRNA疫苗的临床批文,并从2021年5月起开展海外三期临床试验,计划入组28000例。ARCoV的国内第三期临床研究则于2021年7月启动。
据《科创板日报》记者了解,目前ARCoV海外三期临床已完成所有受试者入组,相关研发单位正在等待数据揭盲与分析。
2、斯微生物:斯微生物于2020年初就已针对原始新冠毒株设计开发了mRNA疫苗,但后来随着新冠病毒的几次变异,公司转而针对新冠变异毒株开展疫苗设计与研发,目前正准备申请进入临床试验。
3、艾美疫苗:艾美疫苗mRNA新冠疫苗(LVRNA009)目前已进入关键性II/III期临床试验。在I期临床中,该疫苗显示出了良好的安全性、有效性,公司认为数据结果“超预期”。
4、成都威斯津:成都威斯津生物医药科技有限公司(简称“威斯津生物”),系四川大学华西院士团队于2021年7月创立,其主要的创始人之一宋相容教授曾在哈佛医学院从事mRNA疫苗相关的研究。
据《科创板日报》记者了解,目前该团队开发的针对奥密克戎(Omicron)以及德尔塔(Delta)等新冠变异病毒的mRNA疫苗已向国家药监局申请新药临床研究审批。
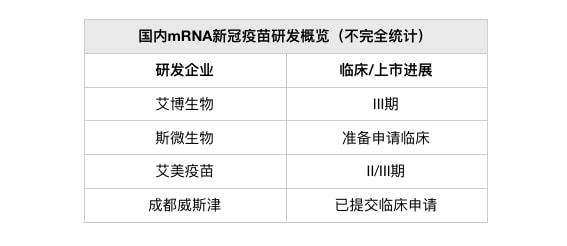
重组蛋白疫苗方面,近期获批的智飞生物(300122。SZ)的重组新型冠状病毒蛋白疫苗(CHO细胞)是国内首个获批上市的国产重组新冠病毒蛋白疫苗。另外,三叶草生物、中国生物、成都威斯克等其他企业亦有布局。
1、三叶草生物:三叶草生物三聚体重组蛋白COVID-19候选疫苗SCB-2019(CpG 1018加铝佐剂)已在一项全球范围的关键性II/III期临床试验中达到主要及次要疗效终点。
据公开信息,公司计划于2021年第四季度就SCB-2019(CpG 1018加铝佐剂)向EMA、国家药监局及WHO提交附条件的监管批准申请。
2、中国生物:临床前有效性研究和初步的人体试验显示,由中国生物研究院科研团队研发的第二代重组蛋白疫苗对多种变异株具有广谱保护潜力。该疫苗在2021年12月底已获阿联酋卫生和预防部批准紧急使用,将作为加强针用于已接种两剂中国生物新冠灭活疫苗的人群。
3、成都威斯克:成都威斯克生物医药有限公司(简称“成都威斯克”)成立于2020年4月,公司核心研发力量为中国科学院院士、四川大学华西医院生物治疗国家重点实验室和肿瘤中心主任魏于全团队。
据《科创板日报》记者了解,威斯克的第一代新冠疫苗目前已经在墨西哥、肯尼亚、印度尼西亚、菲律宾等海外国家推进临床三期,并且还在日本进入了临床1/2期。公司针对omicron变异株的第二代新冠疫苗预计会在今年进入临床。
DNA新冠疫苗方面,在此次新冠疫情之前,全球并无DNA疫苗产品上市。而印度制药公司Zydus Cadila开发的DNA新冠疫苗ZyCoV-D是全球首款用于人类的DNA疫苗,于2021年9月在印度获批上市。
国内企业中,由艾棣维欣与美国Inovio制药联合开发的新冠DNA疫苗pGX9501(INO-4800)在2020年7月获得了临床试验批件,目前正处三期临床阶段。的吸入用腺病毒载体新冠疫苗。
康希诺生物吸入用新冠疫苗,也就是公司已获批上市的新冠疫苗克威莎®的吸入剂型,是克威莎®在制剂配方未改变的情况下,通过吸入的方式进入呼吸道和肺部,从而激发黏膜免疫、体液免疫和细胞免疫三重保护。
据全国政协委员、康希诺生物首席科学官朱涛日前在接受媒体采访时透露,公司吸入式新冠疫苗在去年完成了一、二期的临床,并且已开启部分三期试验。
从已有公开信息看,相较肌注给药的克威莎®,吸入用克威莎®除了可以不用打针外,另一个特点是:可以以更低的接种剂量达到相似的免疫结果。一剂雾化吸入剂量相当于常单剂肌肉注射剂量的五分之一。
因此,如果吸入用克威莎获批用于加强免疫,有望在一定程度上“提高”康希诺的产能。
虽然全球首个获批上市的新冠治疗药物—美国吉利德公司开发的瑞德西韦(Remdesivir)是注射剂,但在新冠治疗药物的开发上,目前业界更多还是将关注点放在口服小分子药物上。
相对注射剂,口服是最常用也是最便利的手段,能大大提高患者的用药依从性,并且在生产、运输上更为方便,产能瓶颈也小。
目前,海外已获批的用于新冠治疗小分子口服药有3款,包括辉瑞Paxlovid、默沙东Molnupiravir以及礼来的巴瑞替尼。
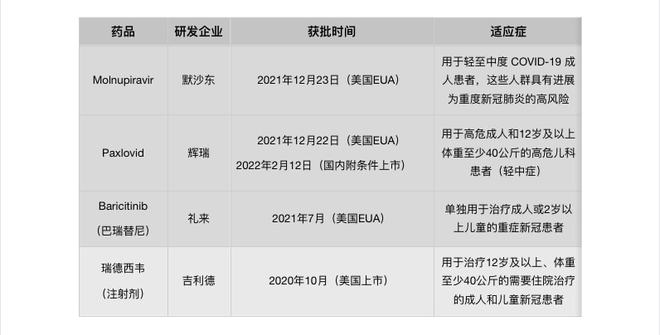
值得注意的是,不管是辉瑞的Paxlovid还是默沙东的Molnupiravir,这两款药物均适用于轻中症的、且有发展为重症风险的新冠感染患者(肥胖、高龄,或罹患糖尿病、心脏病等基础疾病)。
这也意味着, 对无基础疾病的轻中度门诊普通患者以及住院中重度患者的治疗,目前还没有太多的药物可供选择。
此外,近日还有消息传出,由日本制药公司盐野义研发的新冠病毒口服药S-217622已正式向日本厚生劳动省申请生产销售许可。而从公开资料看,这款药物可用于12岁以上的所有轻中症新冠感染患者,但不限定是否具有基础疾病。
国内方面,已布局新冠小分子口服药研发的企业主要有君实生物(688180。SH,、线。HK)等。前沿生物(688221。SH)则布局了注射用新冠小分子治疗药物的研发,拟用于治疗中、重度的新冠肺炎住院患者。
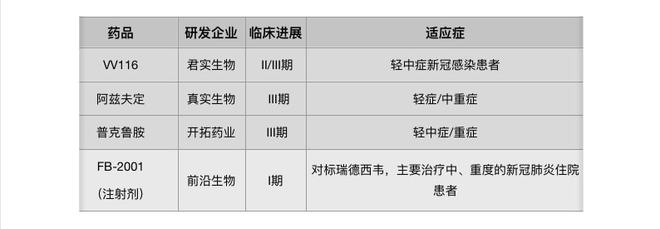
1、 真实生物:河南真实生物科技有限公司(简称“线年,主要致力于抗病毒和抗肿瘤药物、心脑血管以及肝脏疾病等治疗药物的研发。目前,公司阿兹夫定片治疗新冠肺炎的三期临床试验已在中国、巴西和俄罗斯展开。
2、君实生物:VV116针对轻中度COVID-19患者的国际多中心II/III期临床试验正在进行中。另外,2021年12月31日,乌兹别克斯坦卫生部已批准VV116的紧急使用授权。
VV116由上海药物所、武汉病毒所、中国科学院新疆理化技术研究所、旺山旺水、中国科学院中亚药物研发中心共同研发,由君实生物与旺山旺水共同承担该药物在全球范围内(除中亚五国,即哈萨克斯坦、乌兹别克斯坦、吉尔吉斯斯坦、塔吉克斯坦、土库曼斯坦,俄罗斯,北非,中东四个区域外)的临床开发和产业化工作。
3、开拓药业:开拓药业一共发起了3项普克鲁胺治疗新冠的全球多中心临床,包括2项普克鲁胺用于轻中症非住院新冠患者的III期全球多中心临床试验 (编号分别为NCT04870606、NCT04869228)和1项用于重症住院新冠患者的III期全球多中心临床试验(编号为NCT05009732),并于巴拉圭获得针对住院新冠患者治疗的紧急使用授权(EUA)。
其中,编号为NCT04870606的三期临床中期分析并没有达到预期,另外两项临床还在推进中。
4、 前沿生物:FB2001由前沿生物引进自上海药物研究所,公司独家取得该项目在全球范围内的临床开发、生产、制造及商业化权利,并于2021年3月15日在美国启动临床I期试验。2020年12月,FB2001的药物临床I期桥接试验申请又获NMPA批准。
据《科创板日报》记者了解,目前前沿生物正在积极准备FB2001的二/三期临床方案。

访问手机版

微信公众号