近年来,中国实施了修订后的药品管理法和注册条例,目的是加快创新新药的研发。“临床试验60天默示许可”、《接受药品境外临床数据的技术指导原则》等政策的出台,进一步了加速我国创新药物临床试验的启动与相应产品的上市。在这些政策的指导下,中国抗癌药物试验表现出数量上的增长以及形式上的多样化。其中,,传统的I期临床试验的目的是为了探究药物的安全性,以及药代动力学特点等,但近年来有效性探索和分子标志物应用在早期研究中的分量日益增加,创新机制和靶点的涌现也为中国新药研究创造了巨大的机会半岛bandao体育官方。汇总中国早期抗癌药物临床试验数据对促进世界了解中国抗肿瘤药物临床试验的进展及推动全球抗肿瘤新药战略合作具有重要意义。
为此,由国家癌症中心/中国医学科学院肿瘤医院GCP中心李宁教授牵头,由王书航教授、俞悦博士、蒋雅乐博士及福建肿瘤医院张惠姗博士等共同完成了本项报告——中国早期抗肿瘤药物的研发进展。
1.中国抗癌药物I期临床试验逐年增长,免疫类药物尤其是细胞治疗是重点研发对象。
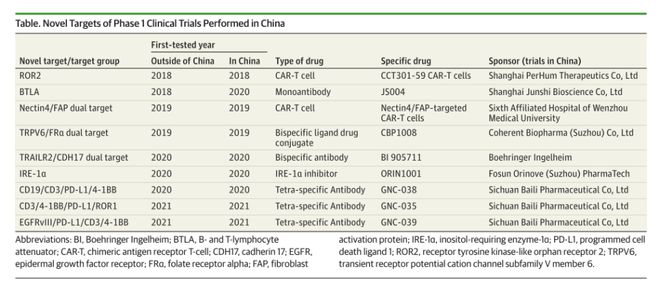
2017年-2021年,中国启动抗癌药物I期试验1359项,AAGR)为23%,共有996种药物进行了I期临床试验。进入I期临床试验最多的药物是肿瘤免疫治疗药物(461, 46%),其中细胞疗法占比最大(200, 20%)。这4年期间,在中国进行了多项创新新靶点的I期临床试验,相应药物包括GNC-035、GNC-038和GNC-039等全球首批四特异性抗体药物;CBP-1008等双配体偶联药物。
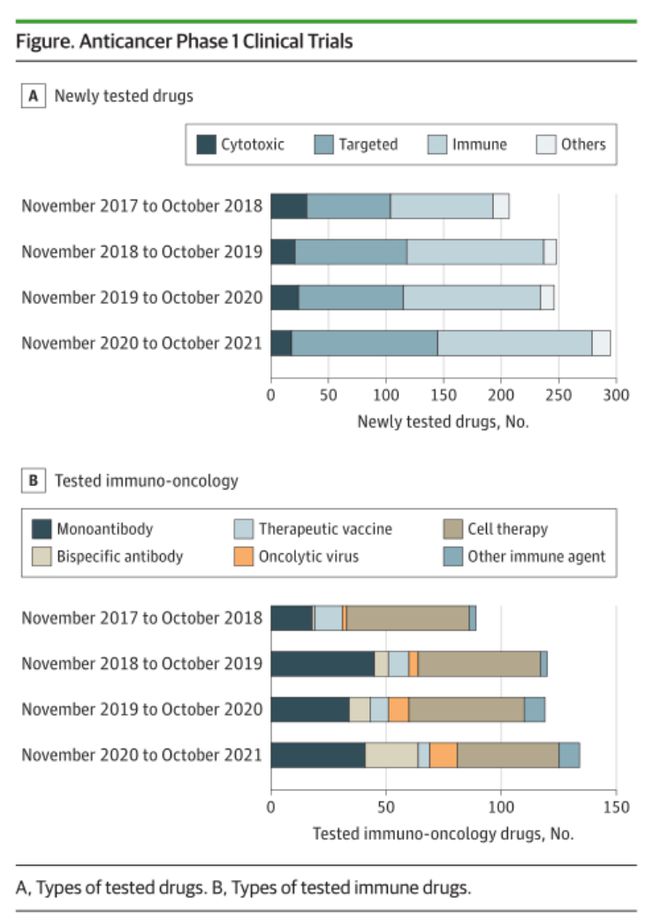
4年间,中国有63项全球多中心I期试验,占总数的不到5%,有很大提高空间。大多数全球多中心试验由中国制药企业发起(32/48,占比67%)。参与中国全球多中心试验的机构主要来自美国(52,83%),其次是澳大利亚(19,30%)和韩国(13,21%)。中国纳入适应性设计的I期临床试验从2017年的67项增加到2021年的123项(AAGR 22%)。共有358项试验(26%)是生物标志物引导的研究(AAGR 21%)。主方案设计也被引入到这些生物标记物引导的试验中,包括伞式试验(2项,占比1%)和篮子试验(13项,占比4%)。
本研究总结了中国药品监管部门发布的临床试验相关政策,展示了中国为全球创新药企业研发创造的有利条件。同时分析了中国近四年抗肿瘤药物早期临床试验的研发现状,主要表现在:创新靶点的first-in-class药物增多,全球多中心试验参与度增加,相同创新靶点中国与全球研发的差距缩小,提高研发效率的适应性试验设计和生物标志物引导的早期研究显著增加,展现了中国早期抗肿瘤药物临床试验的研发趋势和优势,为国内外相关行业了解中国优质的新药研发环境提供了蓝本。
特别声明:以上内容(如有图片或视频亦包括在内)为自媒体平台“网易号”用户上传并发布,本平台仅提供信息存储服务。
财联社2月15日电,尽管支持率落后于特朗普,但黑利誓言会继续竞选直到3月。
1-0半岛bandao体育官方!C罗1000场轰绝杀球,一夜刷爆4大纪录,率队一只脚进亚冠8强!
续航缩短至 2 分钟,三星Galaxy S24 Ultra加速追赶 iPhone。
2023 美国 iPhone 用户画像:13% 来自安卓,表明吸引力下降!
传iPhone 16将配备大幅升级的神经引擎 用于iOS 18的生成式人工智能功能?

访问手机版

微信公众号