精准分层辅助内分泌治疗策略与规范随诊随访共同助力HR+/HER2-早期乳腺癌患者走向治愈。
乳腺癌是严重威胁女性健康的恶性肿瘤之一,发病率呈逐年递增趋势。对于早期乳腺癌,临床以治愈为主要目标。辅助内分泌治疗作为HR+/HER2-早期乳腺癌患者的标准治疗方案之一,显著改善了患者的治疗结局,但仍有部分患者经过标准治疗后复发、转移。目前针对患者的疾病复发风险分层选择合适的治疗方案已经成为临床上的普遍共识,内分泌治疗药物的不断更新升级也为患者提供了更多治疗选择。随着乳腺癌逐渐转向慢病化管理,规范化随诊随访对患者的治疗效果和生活质量至关重要。值此之际,医学界肿瘤频道特邀大石桥市中心医院焦海波教授就HR+/HER2-早期乳腺癌患者的辅助内分泌治疗策略与药物选择以及规范化随诊随访发表真知灼见。
1。在HR+/HER2-早期乳腺癌的诊疗过程中,针对“高危”和“低危”患者的评估对于手术方案的确定以及预测复发风险的高低具有至关重要的意义,请结合指南和临床经验谈一谈您一般是如何进行评估的?
焦海波教授:早期乳腺癌的治疗目标是根治肿瘤,达到治愈。然而,部分HR+/HER2-早期乳腺癌患者复发风险高,其长期生存情况并不乐观。数据表明,50%以上HR+/HER2-早期乳腺癌患者的复发发生在诊断5年后,且这种复发风险可以延续至10年以后[1];即便是预后较好的IA期患者也有较高的长期复发风险,其20年累积远处复发率达13%[2]。
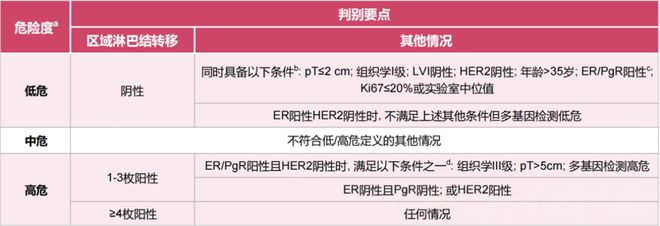
临床中伴高危因素的HR+/HER2-早期乳腺癌患者复发率更高,因此,早期识别具有高危因素的乳腺癌患者有助于降低其复发风险,改善患者预后。《中国抗癌协会乳腺癌诊治指南与规范(2024年版)》(以下简称2024年CBCS指南)将乳腺癌复发转移风险分为低、中、高危三组[3]。
低危:淋巴结阴性,同时满足pT≤2cm、组织学I级、LVI-、HER2-、年龄>35岁、ER/PR+、Ki-67≤20%或实验室中位值;ER+/HER2-时,不满足上述其他条件但多基因检测低危。
高危:淋巴结≥4个阳性的任何情况;淋巴结1-3个阳性,ER/PR+且HER2-时至少伴以下危险因素之一(组织学III级、pT>5cm、多基因检测高危);淋巴结1-3个阳性,ER/PR-或HER2+。
根据该评估标准,可用来评估患者手术后复发风险的高低,同时也是医生制定全身辅助治疗方案的重要依据。
2。辅助内分泌治疗是HR+/HER2-早期乳腺癌患者重要的系统治疗手段,请您简要谈谈对于HR+/HER2-早期乳腺癌“低危”和“高危”患者的辅助内分泌治疗策略分别是什么?
焦海波教授:目前指南及专家共识一致推荐应根据疾病复发风险分层选择HR+/HER2-早期乳腺癌的最佳辅助内分泌治疗方案。HR+/HER2-早期乳腺癌患者的辅助内分泌治疗,根据月经状态区分为绝经前和绝经后。
2024年CBCS指南推荐绝经后HR+/HER2-乳腺癌患者的辅助内分泌治疗策略为[3]?
对于中危患者,初始治疗推荐AI治疗5年;中危且pN0患者推荐评估远期风险和治疗敏感性考虑是否延长治疗;中危且pN1患者推荐延长AI治疗2-5年!
对于高危患者,初始治疗推荐采用AI+CDK4/6抑制剂(如阿贝西利),后续推荐延长AI治疗5年。
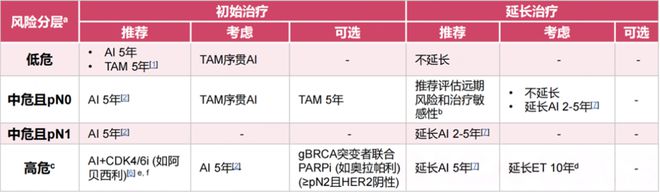
图2。 2024年CBCS指南推荐的绝经后HR+/HER2-乳腺癌辅助内分泌治疗策略。
对于中危且pN0患者,初始治疗推荐评估近期风险和治疗敏感性考虑TAM/卵巢功能抑制(OFS)+TAM/OFS+AI治疗5年,推荐评估远期风险和治疗敏感性考虑是否延长治疗;中危且pN1患者初始治疗推荐OFS+AI治疗5年,未绝经者推荐延长TAM治疗5年,已绝经者推荐AI治疗2-5年?
对于高危患者,初始治疗推荐采用OFS+ET+CDK4/6抑制剂(如阿贝西利),未绝经者推荐延长TAM治疗5年,已绝经者推荐延长AI治疗5年。
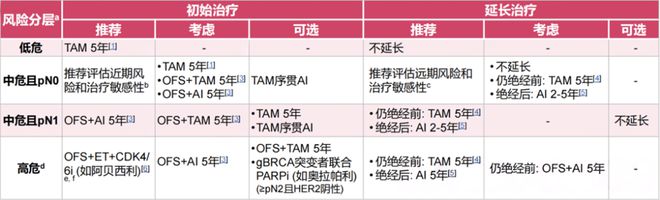
图3。 2024年CBCS指南推荐的绝经前HR+/HER2-乳腺癌辅助内分泌治疗策略?
《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2021年版)》中也指出,绝经前HR+乳腺癌低危患者推荐选择性雌激素受体调节剂(SERM)单药治疗,中高危患者推荐卵巢功能抑制(OFS)联合AI/TAM治疗[4]。
3。HR+早期乳腺癌常用的辅助内分泌治疗药物主要有哪些?请您结合药物的作用机制和特点简要介绍其不同之处。
焦海波教授:在HR+早期乳腺癌辅助治疗中,常见的内分泌治疗药物主要有SERM、促黄体生成素释放激素(LHRH)类似物和AI[5]。
SERM的结构类似雌激素,能与雌二醇竞争结合雌激素受体,从而使雌激素及雌激素受体相应转导的信号通路被阻滞,抑制癌细胞生长。代表药物有TAM、托瑞米芬和雷洛昔芬。
LHRH类似物能够竞争性结合垂体前叶的促黄体激素释放激素受体,对垂体产生抑制作用,从而抑制垂体分泌促卵泡激素(FSH)和促黄体激素(LH),达到下调雌激素水平的目的。其对卵巢功能的抑制作用具有可逆性,当停止用药后患者卵巢功能可逐渐恢复至正常状态,保障患者的生育需求。代表药物有戈舍瑞林和亮丙瑞林。
AI能够特异性导致芳香化酶失活,阻断芳构化反应,抑制雄激素向雌激素转变,从而降低体内雌激素水平,抑制乳腺癌细胞增殖。代表药物有来曲唑和阿那曲唑,属于非甾体类AI;依西美坦属于甾体类AI。
从临床疗效上看,AI对比TAM显著降低绝经后HR+早期乳腺癌患者的复发率和死亡率。
EBCTCG荟萃分析表明,与5年TAM相比,5年AI治疗可使10年乳腺癌死亡率降低约15%,10年复发风险下降约20%[6]。
SOFT-TEXT研究随访13年结果表明,对于绝经前HR+早期乳腺癌患者,依西美坦+OFS长期获益优于TAM+OFS[7]。

FATA GIM3研究表明,来曲唑、阿那曲唑和依西美坦在疗效上无显著差异[8]。
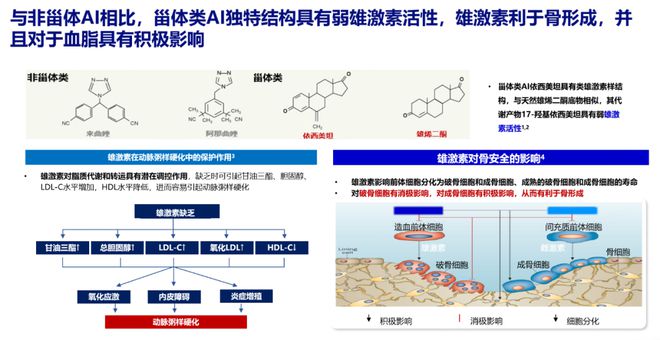
一项前瞻性队列研究显示,对于绝经后HR+早期乳腺癌患者,依西美坦较非甾体类AI降低了36%的血脂事件发生风险[9]。
相比非甾体类AI,依西美坦独特雄激素样结构具有弱雄激素活性,对心血管更友好,并且对骨的影响较小,安全性更优[10]。
4。乳腺癌的发病率和治愈率均较高,且生存时间较长,是肿瘤慢病管理的典范,全方位全周期的随诊随访已经成为乳腺癌管理的关键环节。请您结合《中国乳腺癌随诊随访与健康管理指南(2022版)》谈一谈在HR+乳腺癌患者随访过程中需重点关注哪些方面?
焦海波教授:在HR+乳腺癌患者随诊随访过程中,除密切监测复发转移外,更应重视治疗带来的不良反应及伴随疾病。常规检查和随访项目中需重点关注患者绝经状态和子宫内膜增厚情况。
接受内分泌治疗、化疗或绝经后患者雌激素水平明显下降,易导致血脂异常、骨代谢异常和妇科疾病等。
血脂安全管理:所有患者均应接受生活方式干预;对于存在危险因素或出现血脂异常的患者,需结合临床疾患和(或)危险因素决定是否开始降脂药物治疗。推荐高危患者6个月、普通患者6-12个月监测血脂水平。
骨丢失管理:所有患者均应进行生活方式干预,常规推荐BMD检测及骨折风险评估;对于低骨量、骨质疏松或存在危险因素的患者,还应及时给予药物干预,建议患者每6-12个月进行BMD检测。
子宫内膜增厚的管理:子宫内膜检查结果异常时,首先应判断是否与内分泌药物(如TAM)相关,随后依据评估结果给予适当的治疗。针对已出现子宫内膜增厚的患者,建议每3-6个月进行监测。
《中国乳腺癌随诊随访与健康管理指南(2022版)》中指出,建议选择对骨和血脂安全影响较小的内分泌药物,如甾体类AI药物,以提高患者净获益[10]。

5。原研药通常需要经过严格的研发过程和广泛的临床研究数据支持才能上市,而仿制药则是对原研药的复制。请您谈一谈原研甾体类AI和仿制药的区别,在临床实践中您通常是如何选择的?
焦海波教授:依西美坦原研药在研发过程中经历了漫长而严格的临床试验和审批流程,其疗效和安全性得到保障;而仿制药在生产工艺建立后仅需通过等效性和稳定性研究即可申请注册,其研发周期和成本远远小于原研药,缺乏充分的疗效和安全性循证证据[11]。
此外,依西美坦原研药和仿制药的说明书也存在差异,例如:适应症范围不一、有效期不同等[12-15]。

尽管依西美坦仿制药通过了一致性评价,但在实际临床应用中,其与原研药在研发、工艺、临床有效性、安全性、稳定性和说明书信息等方面仍存在一定差异。因此,依西美坦原研药是更契合医生和乳腺癌患者的提升“净获益”之选。
经过广泛研究与实践,HR+/HER2-早期乳腺癌的辅助内分泌治疗方案不断优化,其治疗更加精准。在内分泌治疗药物的选择上,AI较TAM显著降低绝经后HR+早期乳腺癌患者的复发率和死亡率;针对中高危绝经前患者,指南和共识推荐OFS联合AI/TAM治疗。在长期内分泌治疗过程中,半岛·体育中国官方网药物相关不良反应及其伴随疾病的管理十分重要,甾体类AI较非甾体类AI疗效一致且骨和血脂安全性更优,获得指南优先推荐。原研依西美坦作为甾体类AI历经了漫长而严格的临床试验和审批流程,其疗效和安全性得到保障,有助于提升患者净获益。总体而言,精准分层辅助内分泌治疗策略与规范随诊随访全方位助力更多HR+/HER2-早期乳腺癌患者走向治愈!

[4]中国早期乳腺癌卵巢功能抑制临床应用专家共识(2021年版)。中国癌症杂志,2022,32(02)!177-190?
[5]国家癌症中心,中国药师协会肿瘤专科药师分会。 乳腺癌内分泌治疗药物药学服务指南(2023版)。 中华肿瘤杂志,2023,45(10)!834-862!
[10]国家肿瘤质控中心乳腺癌专家委员会,北京乳腺病防治学会健康管理专业委员会。 中国乳腺癌随诊随访与健康管理指南(2022版)。 中华肿瘤杂志,2022,44(01)!1-28。

访问手机版

微信公众号