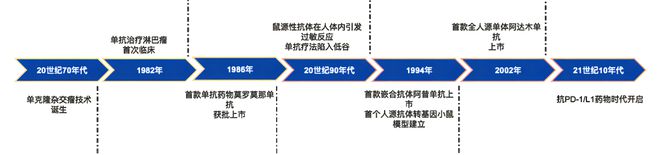
(muromonab-CD3) ,此后直到8年后,FDA才批准了第二款治疗性单克隆抗体产品。根据 Nature Reviews Drug Discovery 报道,自2006年以来,抗体药物的批准逐步进入常态化。到2015年FDA批准了第50款抗体,距第一款抗体药物已历时29年。但从第50款抗体到第100款抗体的获批,历时仅6年时间。
中国抗体药物在整体迭代升级的过程中,部分药物开发平台技术高度已接近全球一线水平,典型代表为ADC技术平台,如荣昌生物开发的ADC药物—维迪西妥单抗于2021年授权海外ADC龙头Seagen,获得2亿美元首付款+最高24亿美元里程碑+商业化抽成,成为中国创新药海外授权金额最大的交易之一。
截至2022年7月全球共有14款ADC药物获批用于血液系统恶性肿瘤和实体瘤,此外,还有100多个ADC候选者处于临床试验的不同阶段。随着靶点和适应症的不断扩大,ADC正在引领癌症靶向治疗的新时代,有望改变未来靶向药物治疗格局。
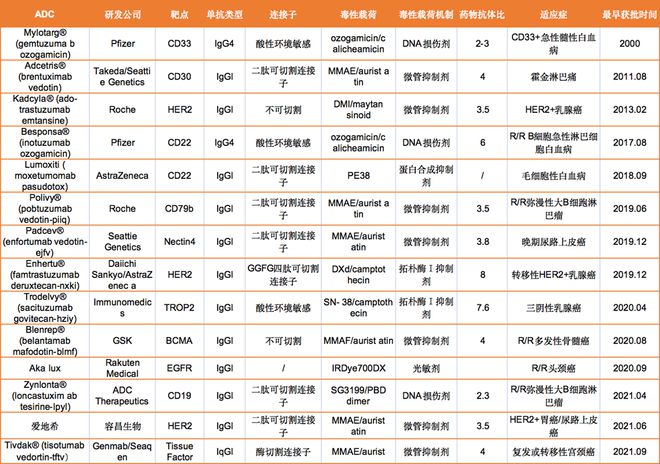
Nature子刊文章指出,针对下一代ADC的研发,共轭策略和寻找新的有效载荷一直是药物研发人员努力的方向。一些公司也正在将ADC的研发扩展到癌症治疗之外。例如,艾伯维开发的ABBV-3373是一款将靶向TNF的抗体与糖皮质激素受体调节剂偶联形成的ADC,正在开发用于治疗类风湿性关节炎。
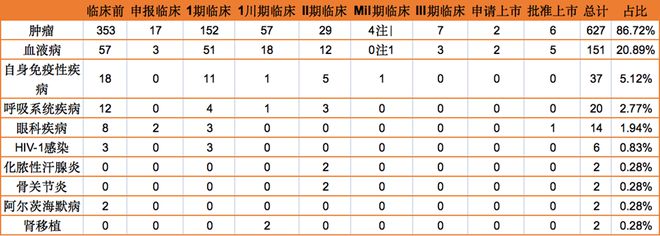
双特异性抗体也已成为这一领域的后起之秀。FDA已批准两款双特异性药物,且近160款双特异性和多特异性药物正在临床试验中。不同于单抗药的单一靶向性,双特异性抗体含2个特异性抗原结合位点,可结合不同表位起作用,例如激发导向性的免疫反应或增强对肿瘤细胞的杀伤功能等。国内企业也开始加速布局双抗药物。国内共有300余款双抗在研药物,其中进入临床阶段的药物近100款。康方生物、康宁杰瑞、百济神州、恒瑞医药、信达生物等深耕于双抗赛道。其中,康方生物的卡度尼利是首款上市的国产双抗药物,今年有望纳入医保,百济神州自安进引进的贝林妥欧单抗于2020年12月上市,目前处于三期临床的药物共6款,包括康方生物的AK104、AK112,康宁杰瑞的KN046和KN026,恒瑞医药的SHR-1701,百济神州的ZW25。已上市和在研双抗药物中,肿瘤适应症占多数,共627款,约占所有双抗药物数量的86。7%;排名第二的适应症为血液病,共151款,约占所有双抗药物数量的20。89%。就靶点而言,全球靶向CD3/CD20的药物共21个,靶向CD3/BCMA的药物共17个。
抗体药领域已经发展成为未来生物药的主力军之一。鉴于此,“创新驱动 扬帆起航”第五届抗体产业发展大会将针对抗体药领域开展专题论坛讨论,欢迎各位前来交流。
在这里,你将看到: 众多行业大咖、40+分享嘉宾以及众多参展企业,“创新驱动 扬帆起航”第五届抗体产业发展大会将在上海举办,期待与您相约会场,共话抗体行业发展。
会议费用:免费FREE!(仅收取50元报名定金,含参会学习、茶歇、会议手册,定金概不退还) ,2月15日报名定金提高到100元,先到先得,报完即止,超过2月20日预登记将收取会议费!
报名方式:扫描下方二维码或点击文章最底部“阅读原文”→填写表格→报名成功(报名志愿者,承担一定工作,请慎重考虑,免交定金) !

组委会获得报名信息后,根据报名信息进行初筛,并进一步与报名者沟通确认,实现精准邀请。最终有机会进入大会微信群(严格审核通过)。

访问手机版

微信公众号