半岛平台原标题:广生堂9亿募资告吹,部分用于新冠药研发,转型创新药未果扣非净利连亏2年!

5月25日晚,广生堂的9。48亿募资宣告失败。在历时四个多月,经历2轮问询后,广生堂最终还是终止了2023年度向特定对象发行A股股票事项,并向深交所申请撤回相关申请文件。
在监管问询中,重点对广生堂的业绩、募资用途、在研产品风险等问题进行发问。这些问题的背后,是对广生堂可持续发展的担忧。
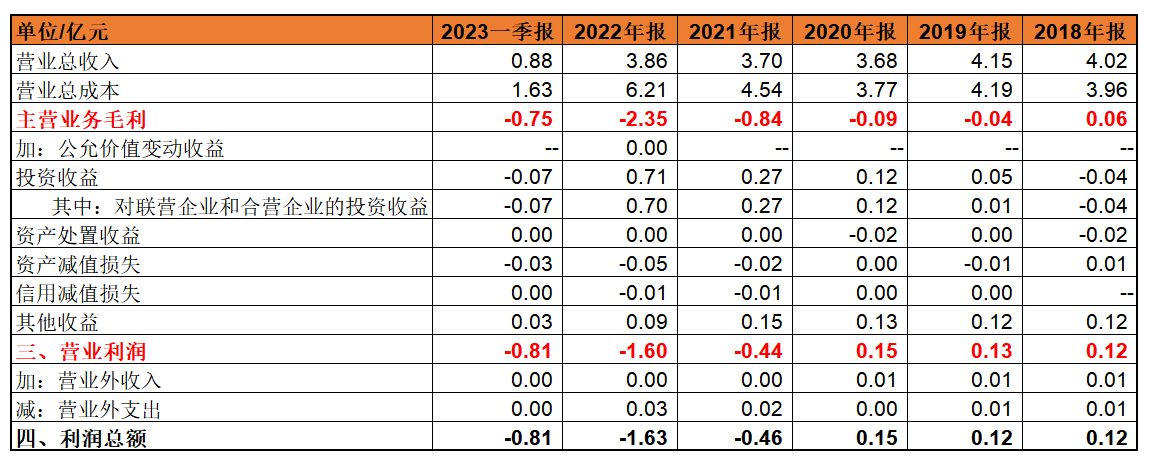
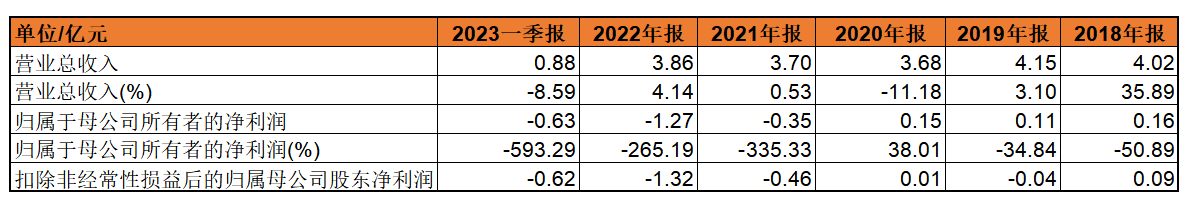
2019—2023年1-3月,广生堂的主营业务毛利已连续亏损4年。其中,2019年、2020年凭借投资收益勉强扭亏为盈。而自2021年起,广生堂的归母净利润、扣非净利润也已连续亏损2年。
广生堂的困局源自其核心产品纳入集采后,毛利率大幅下滑,与此同时却未能推出新产品以支撑业绩。
截至目前,广生堂的仿制药板块共有4款在研产品,但其中3款已纳入集采;而剩余的1款产品,如今市场上已有5款产品获得药监局的批文。
创新药方面,从研发进度来看,短期内最有可能为广生堂贡献利润的便是新冠口服小分子创新药GST-HG171,在此次募得资金部分用于该产品的研发。
包括辉瑞、默沙东在内,国内已有6款新冠药获批。除此之外,还要不少企业在研的新冠药已进入临床Ⅲ期。

5月25日晚,广生堂的9。48亿募资宣告失败。对于终止原因,广生堂在公告中表示,终止本次向特定对象发行股票事项是综合考虑当前资本市场环境变化情况、业务发展规划及资本运作计划等诸多因素后作出的决策。
从监管层的问询来看,监管层主要对广生堂的业绩、募资用途、在研产品风险等问题进行发问。
5月16日晚,广生堂再度收到监管问询,要求广生堂对投资收益对利润贡献的问题进一步解释,并要求广生堂于五个工作日内提交。
2018—2023年1-3月,广生堂的投资收益对利润的贡献或者收窄亏损,或者扭亏为盈。
广生堂的投资收益主要来自参股企业福建博奥医学检验所有限公司(下称“福建博奥”)和莆田博奥医学检验有限公司(下称“莆田博奥”)。2020 年新冠病毒爆发以来,福建博奥、莆田博奥相继开展核酸检测业务。
抛开投资收益,2019—2023年1-3月,广生堂的主营业务毛利连年亏损,2022年已从2019年的亏损0。04亿扩大至2。35。2021年至2023年一季度,广生堂的归母净利润?
资料显示,广生堂创建于2001年6月,2015年4月在深圳证券交易所成功上市。主要从事肝病及抗病毒、抗感染治疗药物领域的研发、生产及销售。
从数据上,近三年广生堂的营业收入虽然增长幅度小,但稳中有升且与利润背道而驰。据广生堂解释,主要是加大对创新药研发的投入导致研发费用增加,短期内效益暂未显现所致。此外,抗乙肝病毒产品销售价格受集采政策影响下降导致的毛利减少,以及加大保肝护肝药物及新产品市场开拓导致。
事实上,当下广生堂的处境颇为尴尬。医保控费、集中采购等政策导致其核心产品毛利大幅缩水;与此同时,广生堂旗下并没有出现新品作为业绩支撑。
从数据来看,作为广生堂的核心产品抗乙肝病毒类药物集采及非集采毛利润差距颇大。2020—2022年1-6月,非集采产品的毛利率为77。68%、73。02%、68。84%;而集采产品的毛利率分别为31%、27。07%、18。54%。
近年来,广生堂在创新药研发领域进行了较大规模的研发投入,在盈利能力欠佳的当下,其资金压力显而易见。广生堂在公告中也提及,其日常经营存在一定资金压力。
2021年6月广生堂曾向特定对象发行人民币普通股1877。70万股,共募集资金5。14亿,扣除相关的发行费用后实际募集的资金近5亿。彼时,广生堂的募资用途主要是生产基地、车间建设及补充流动资金,其中1。6亿用于补充资金,占计划募资金额的29。09%。
根据此次预案,广生堂拟向特定对象发行A股股票拟募集资金总额不超过9。48亿(含),扣除发行费用后将全部用于创新药研发项目、补充流动资金。

一面是被大环境挤出的利润,一面是新业绩支撑的缺失,广生堂的困境,是一众仿转创药企的一个缩影。
自IPO上市以来,广生堂便明确向创新药企转型,2016年起广生堂陆续启动多个肝病、抗病毒领域的创新药研发,与全球领先的创新药研发企业合作研发多个全球一类创新药,旨在成为抗病毒和肝脏健康药物领域领先的创新药企业。
由于医药行业的特性,投入回报周期较长,且广生堂的创新药研发主要集中于临床前研究阶段和临床 I、II期阶段。
广生堂此次募集的9。48亿资金中拟将7。48亿用于创新药研发项目,主要用于补充项目临床试验费用,包括创新药GST-HG171、GST-HG141、GST-HG121的 II/III 期临床研究。
其中,GST-HG171是新冠口服小分子创新药,与辉瑞的Paxlovid同属3CL蛋白酶技术路线。目前已进入 II/III 期无缝设计的关键性注册临床试验。
GST-HG141及GST-HG121均为针对乙肝治疗的创新药,其中GST-HG141已完成I期临床试验,试验结果积极,并已获得II期临床试验组长单位伦理委员会批件;GST-HG121目前正在开展I期临床试验。
除了前述三条管线外,在研创新药还包括目前处于临床II期的GST-HG16,正在进行I期临床研究的GST-HG151。
从研发进度来看,短期内有望为广生堂贡献收入变为新冠口服小分子创新药GST-HG171。
今年1月9日晚间,广生堂曾公告,GST-HG171具有优越的抗新冠病毒疗效,新冠患者核酸转阴时间明显优于阳性对照Paxlovid及安慰剂对照,同时安全性和耐受性良好,达到试验预期目的。
值得一提的是,GST-HG171的疗效是建立在28天的临床观察数据之上。据彼时公告,该试验于2022年11月22日至12月29日完成61例COVID-19患者招募和治疗。
继首个国产新冠药阿兹夫定上市后,2023年1月29日,先声药业的新冠口服小分子药先诺欣和君实生物的民得维均获附条件批准上市,截至目前包括辉瑞的Paxlovid、默沙东的Molnupiravir在内共有6款新冠药获批,国产4款、进口2款。
除了已经上市的新冠药,目前众生药业的RAY1216片、开拓药业的普克鲁胺(AR拮抗剂)均处于临床Ⅲ期,石药集团的SYH2055、齐鲁制药的QLS1128、艾森药业的STI-1558、歌礼制药的ASC11均进入临床I期。
在研仿制药方面,主要包括硫酸氢氯吡格雷阿司匹林片、熊去氧胆酸胶囊、盐酸达泊西汀片、丙肝治愈核心用药索磷布韦片4款产品。其中,前三款均已纳入集采目录。
而索磷布韦片也面临激烈竞争。据国家药品监督管理局数据,搜索索磷布韦片,四环制药在内共有4家药企的索磷布韦片已获批。

访问手机版

微信公众号